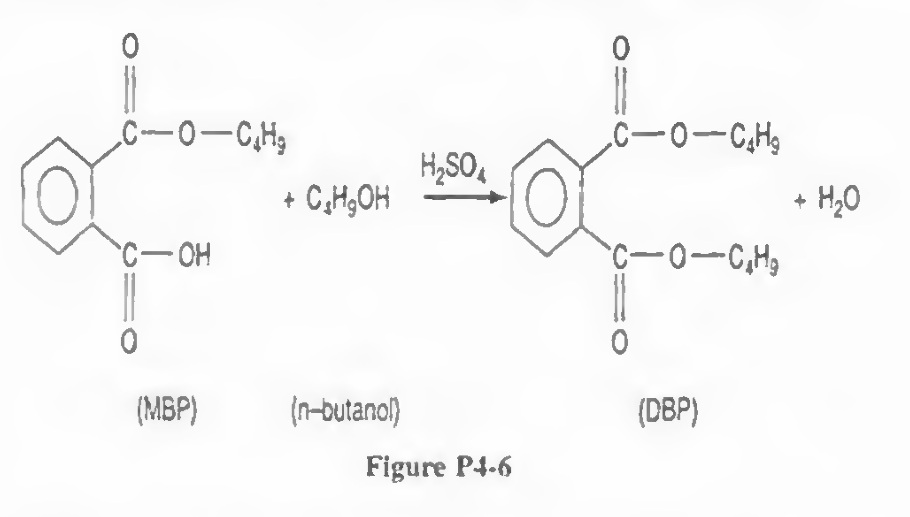
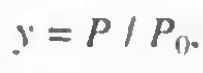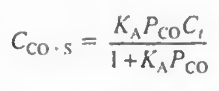"자발성"은 시스템의 최종 상태와 초기 상태 사이의 깁스 자유 에너지 차이를 의미하기 때문이다. 따라서 "자발성"은 열역학적 양이며, 우리는 열역학이 초기 상태에서 최종 상태로 이동하는 데 필요한 시간이나 경로, 시스템이 사용하는 메커니즘에 관심이 없다. 방금 언급한 모든 것은 화학 반응 속도론 분야에 속한다. 반응은 자발적일 수 있지만 동시에 매우 느릴 수도 있다. 다이아몬드가 흑연으로 변환되는 것은 자발적이지만(실내 조건에서) 보석상에게 안심을 주기 위해 매우 느리다. 열역학이 속도론으로 연결되면, 우리 모두는 즉시 죽어야 한다..