저번 요약:
★엔지니어의 목표는 인류에게 유용한 물품을 제작하는 것이며 화공 엔지니어는 화학 물품을 제조하는 공정을 창조한다. 화공 엔지니어는 설계문제를 푸는데, 이는 개괄적 목표를 예비 설계를 통해 정교한 서술로 바꾸는 작업이다.
★예비 설계가 막막하다면 다음의 스텝을 따라라
1.명확한 목표를 정의하기
2.정보수집:완전히 새로운 공정 설계는 거의 없다.
3.대안 표현: 하나의 case를 만들어서 시작점으로 잡고 나머지를 만들어본다.
4.대안 평가
2장: 공정도를 만드는 법을 배운다.
3장: 공정도에 나타나는 물질 및 에너지 수지를 계산한다.
4장: 장치비와 조업비를 배운다 (?)
5장: 주어진 설계에 대한 경제적 가치 평가.
6장: 회분 공정에서 어떤 장치를 추가 구매할 것인지
이때 대안의 폭발을 막기 위해 더글라스 계층 구조가 제시되었다. 이는 후보 공정도를 생산하는 좋은 방법이다.
1단계: 회분 or 연속 공정
2단계: 입출력 구조
3단계: 재순환 구조
4단계: 분리 체계 합성
4a:기체 회수
4b:액체 회수
5단계:열교환망 합성
-----------
에탄올 공정의 합성:사례연구
이번 독서노트에서는 순도 96%의 에틸렌으로 에탄올을 제조하는 공정의 기초 사례 공정도를 개발하기 위해 한계값 전략과 더글라스 계층구조를 적용한다.
먼저 자본과 운전 비용의 한계값을 결정함으로써 공정 설계를 시작할 수 있다. 이윤이 생기는지 생기지 않는지 검사하는 것으로, 만약 생기지 않는다면 공정을 만들 필요가 없기 때문이다.
1.가능한 최대 이윤
:한 공정에서 가능한 최대 이윤은 생산물 가격-원료의 최소 금액이다. 반응의 양론관계, 몇 가지 물성값, 에틸렌, 물, 에탄올에 대한 가격이 분석을 위해 필요하다.
C2H4 + H2O → C2H5OH
C2H4 + C2H5OH → C2H5OC2H5
에틸렌과 물이 반응하여 에탄올이 생성되지만, 부 반응으로 에틸에테르도 생성되게 된다.
이들의 가격을 chemical marketing reporter 라는 책에서 인용해보기로 하자.

여기서 에탄올과 에틸 에테르는 생성품으로, 가격을 그대로 적용해도 된다.
그러나 항상 주의해야 할 것은 재료이다. 재료의 가격이 0.28~0.30 달러라고 그대로 적용하면 안된다. 그 이유는 재료의 순도 때문이다. 공급되는 에틸렌이 100%라면 좋겠지만, 대부분은 분리 문제로 인해 불순물이 섞이기 때문이다. 이번에 공급되는 에틸렌은 순도가 낮다. 따라서 파운드당 0.18달러 정도를 얻을 수 있다고 가정해보자.
이 가격을 이용하여 다음과 같이 총 이윤의 상한을 추산한다.
1. 얼마만큼 생산할 것인가??
: 에탄올을 1년에 150000m3 씩 생산한다고 가정한다. 이는 회사의 재정이나 수요등 여러가지를 고려하여 도출해야 한다. 이는 39600000gal/yr이다. 가격 범위는 위 표를 이용해 계산하면 1년에 $101000000에서 $111000000이다.
2.여기서 재료비를 빼야 이론적인 가격을 계산할 수 있다. 에탄올을 1년에 150000m3 씩 생산할 때 드는 물과 에틸렌의 양을 양적관계로 계산해보자.
Q 190도 에탄올 150000m3 에 들어있는 에탄올의 몰수는?
---------------------------
에탄올의 몰수를 계산하려면 먼저 에탄올의 분자량을 알아야 합니다. 에탄올은 C2H5OH 분자식을 가지며, 탄소(C) 원자의 상대 원자 질량은 약 12.01, 수소(H) 원자의 상대 원자 질량은 약 1.01, 산소(O) 원자의 상대 원자 질량은 약 16.00입니다.
에탄올(C2H5OH)의 분자량을 계산해보겠습니다:
분자량 = (2 * 분자량(C)) + (6 * 분자량(H)) + 분자량(O) 분자량 = (2 * 12.01) + (6 * 1.01) + 16.00 분자량 = 24.02 + 6.06 + 16.00 분자량 = 46.08 g/mol
이제, 150,000 m^3의 에탄올을 고려합니다. 몰수 계산에 사용되는 공식은 다음과 같습니다:
몰수 (mol) = 질량 (g) / 분자량 (g/mol)
질량을 계산하려면 부피와 밀도를 고려해야 합니다. 에탄올의 밀도는 온도와 압력에 따라 다르지만, 일반적으로 약 0.789 g/cm^3입니다. 1 m^3는 1000 L이므로 밀도를 사용하여 질량을 계산합니다:
질량 (g) = 부피 (m^3) * 밀도 (g/cm^3) * 1000
질량 (g) = 150,000 m^3 * 0.789 g/cm^3 * 1000 질량 (g) = 118,350,000 g
이제 몰수를 계산할 수 있습니다:
몰수 (mol) = 118,350,000 g / 46.08 g/mol 몰수 ≈ 2,568,001.38 mol
따라서 150,000 m^3의 에탄올에는 약 2,568,001.38 몰의 에탄올이 들어있습니다.
----------------------
따라서 2,568,000몰의 에틸렌이 필요하다고 가정한다. (C2H4 + H2O → C2H5OH)
이제 에틸렌이 에탄올로 100% 전환한다고 가정하고, 다음과 같이 도입의 총 무게를 계산해보자.
2,568,000 몰 * 28.05 kg/몰 = 72032400 kg EL / yr
(에틸렌 순도 96%, 3%의 PL, 1%의 M으로 이루어져있음이 밝혀졌다고 치면)
총 공급량은 72032400 kg / X = 0.96에서 X=75033750kg
EL:72032400 (96%)
PL:2251012.5 (3%)
M:750337.5 (1%)
이 원료의 가격은 75033750kg * 2.2046lb * 0.18$ =29775500 $/ yr
물의 가격을 무시한다고 치면,
제품판매 비: $101000000에서 $111000000
원료비 29775500 $
약 71000000$/yr에서 81000000$/yr 정도의 최대 이익이 나옴을 알 수 있다. 다만 이는 운전비용과 공정 장치 투자비의 연간 환산 비용을 고려하지 않은 것이다. 자세한 사항이 주어지면 이를 계산하여 뺌으로써 정확한 비용 추산이 가능해질 것이다.
2.더글라스 계층 구조를 이용한 공정도 개발
1단계: 회분 OR 연속 공정
회분공정을 선택하는 이유는 빠르게 개발해야 하거나 또는 생산이 단 며칠만에 끝나는 경우이다. 그러나 에틸렌을 에탄올로 바꾸는 이 작업에서는 둘다 해당하지 않으니 연속공정을 택한다.
2단계: 입출력 구조
에틸렌 도입은 96몰%의 에틸렌과 3몰%의 프로필렌, 1몰%의 메탄으로 이루어져 있다.
에틸렌의 단일 반응당 에탄올로의 전환율은, 위에서는 100%로 가정했지만 실제로는 7%에 해당하므로 공정 재순환의 효과와 불순물과 비활성 성분을 고려할 필요가 있다. 프로필렌과 메탄은 궁극적으로 공정에서 제거되어야 한다.
입출력 구조를 만들기 막막할 때 대안을 찾을 수 있다. 모든 설계문제는 이미 해답이 어느정도 나와있음에 주의하라.
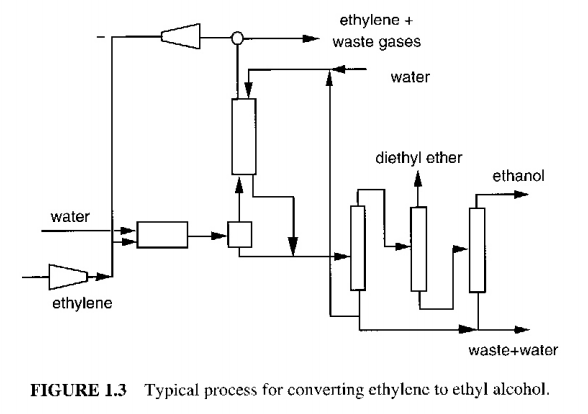
문헌에서 에틸렌을 에탄올로 전환시키는 공정을 찾을 수 있었다. 이를 시작점으로 삼아 설계를 발전시킬 것이다. 왜 이것을 바로 공정에 적용할 수 없는가?
->재료로 순수한 에틸렌만이 사용되므로 현 상황과 맞지 않다.
따라서 메탄과 프로필렌을 포함하여 다음의 3가지 반응기와 분리기 배치를 고려해볼 수 있다. (기호는 밑에 참고 2을 참고하시오 ㅋㅋ)
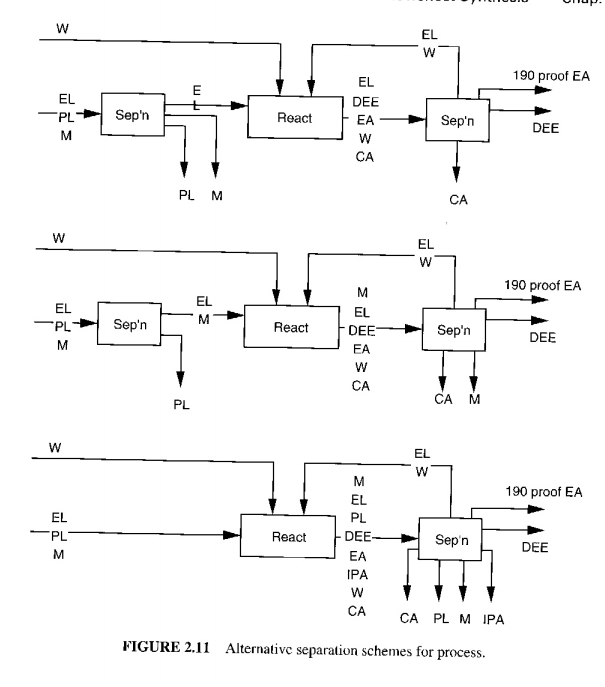
1.먼저 분리기로 PL과 M을 다 없앤 후 순수 에틸렌을 반응기에 넣는다.
2. PL만 제거하고 에틸렌과 메탄은 포함해서 넣는다.
3.그냥 다 반응기에 넣고 이후 분리기로 PL과 M을 제거한다.
그러나 문제는 분리기에서 메탄과 프로필렌을 분리하기가 어렵다는 것이다.따라서 1은 기각이다. 2는 왜 안되는가? 일단 끓여서 분리하고 나면 반응기에 넣기 위해 냉각이 필요한데, 번거롭고 가격이 많이 들기 때문이다. 따라서 일단 반응기에 다 넣어버리는 3을 택하는 것이 추천된다.
참고) 에틸렌(ethylene)과 프로필렌(propylene)의 분리는 일반적으로 어렵지는 않습니다. 이것이 2의 공정도가 가능한 이유입니다. 그러나 에틸렌과 메탄을 분리하기는 어려우며 그 이유는 다음과 같습니다:
- 유사한 물리적 특성: 에틸렌과 메탄은 둘 다 탄소와 수소 원자로 이루어진 가스로, 분자량이 비슷하며 비슷한 물리적 특성을 가지고 있습니다. 이는 두 가스를 빠르게 분리하기 어렵게 만듭니다.
- 용매의 한정된 효과: 에틸렌과 메탄을 분리하기 위해 사용되는 용매나 분리 기술은 이들의 물리적 및 화학적 유사성 때문에 한정된 효과를 보일 수 있습니다.
- 열적 안정성: 에틸렌과 메탄은 열적으로 안정하게 동작하므로 열 확산 또는 열 분리 프로세스를 통한 분리가 어려울 수 있습니다.
참고 2)
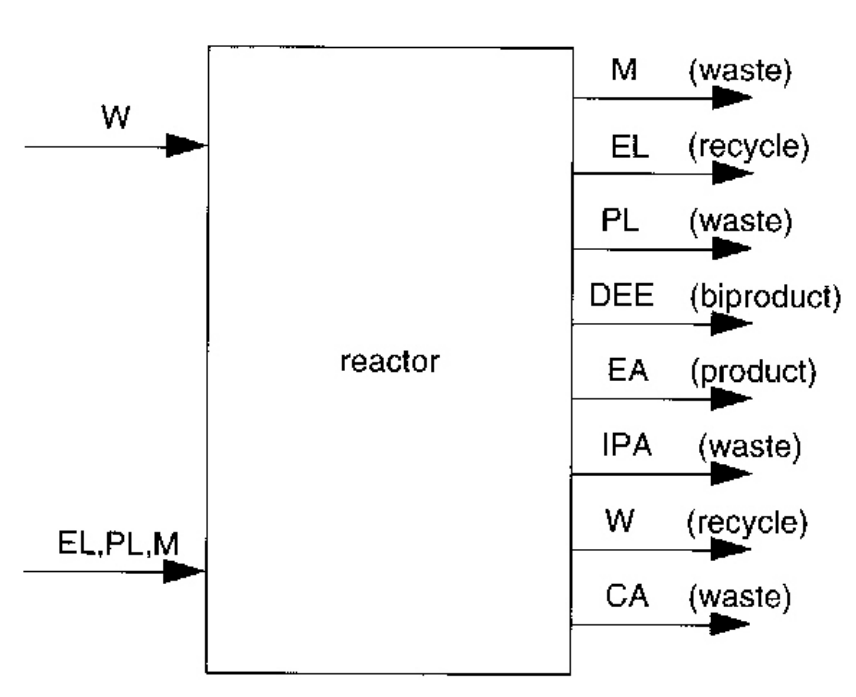
문헌에서 에틸렌을 물과 반응시켰을 때 생기는 모든 부산물을 찾아볼 수 있다.
M:메탄 (공급 피드에 있는 불순물)
EL:에틸렌(반응 안된 것임)
PL:프로필렌 (공급 피드에 있는 불순물)
DEE: 다이에틸 에테르(Diethyl Ether)
EA:에틸 에테르
IPA:이소프로필 알코올(Isopropyl Alcohol)
W:물
CA: 크로톤 알데하이드 C4H6O
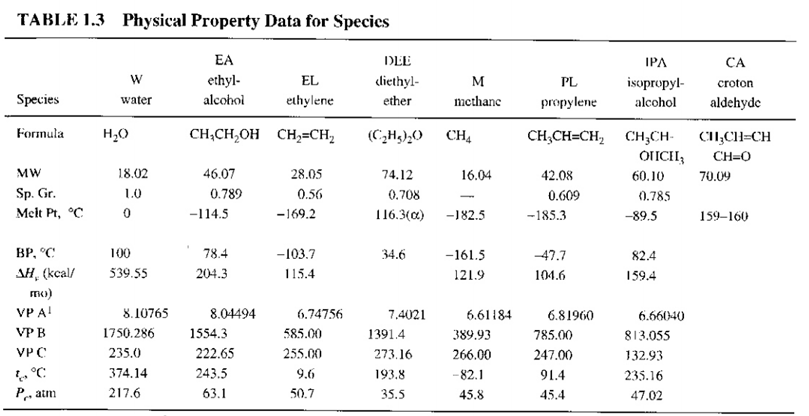
각 성분별 물성은 다음과 같다.
3단계: 재순환 구조
이 단계에서는 반응기에 초점을 맞춘다. 반응기로 도입된 원료 물질이 부산물로 전환되면 가격손실이 발생한다. 예를 들어 다음 화학반응을 고려해보자.
reaction1 : A + B -> C
reaction 2: 2A -> D
여기서 C가 원하는 제품이고 D가 부산물이라고 치면, 반응 1 2는 항상 함께 발생하게 되므로 손실을 피할 수는 없다. A의 60%가 전환되었을 때 C가 50% 생성되면 A의 C에 대한 선택도는 0.5/0.6 = 0.83이다
미반응 A는 재순환하여 모든 A가 전환되게 할 수 있다. 여기서 선택도가 높을 수록 좋으며 만약 A의 30%가 전환되었을때 선택도가 최대가 된다면 30%만 반응시키는 작업을 계속 순환시켜 부반응을 최소화할 수 있다.
이제 본 사례의 반응으로 돌아가보자.
반응 1: C2H4 + H2O → C2H5OH
반응 2: 2 C2H5OH -> C4H10O + H2O
에틸렌이 알코올로 되는 반응이 있더라도, 알코올이 DAA로 변환되는 부반응이 존재한다. 이를 억제할 수 있는 방법은 평형상수를 찾아보는 것이다. 2번째 반응의 평형상수는 다음과 같다.
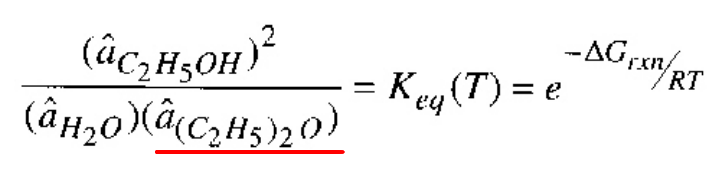
이 반응의 평형 상수가 낮을 수록, 정반응이 억제된다. 따라서 평형상수를 낮추기 위해서는 반응기 내부에 DAA가 많아야 한다. 따라서 한번 생성된 DAA를 계속 반응기로 재순환시키면 억제될 것이다.
재순환시켜서 부반응을 100% 억제했다고 가정해보자.
4단계: 분리 체계 합성
이제 기초 분리 공정을 설계해보자.
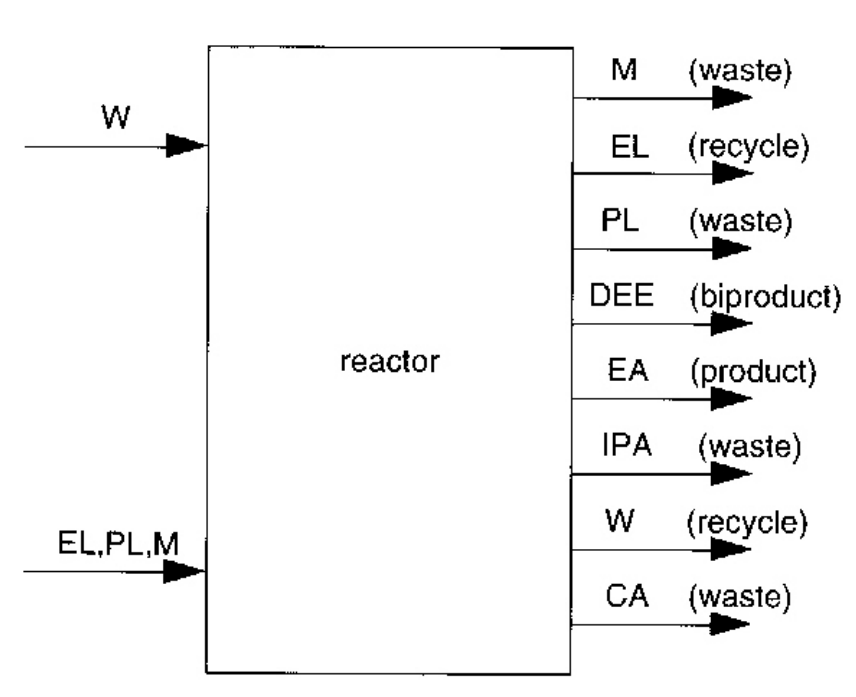
일단 이렇게 부산물이 생성되는데, 가능한 분리 공정 기술을 모두 열거해보면 다음과 같다: 증류, 플래쉬, 흡수, 추출 증류와 흡착. 더 많은 것이 존재하므로 일단 다 열거해놓는게 좋다.
이제 각 방법을 적용했을 때 나올 수 있는 가짓수를 생각해보자.
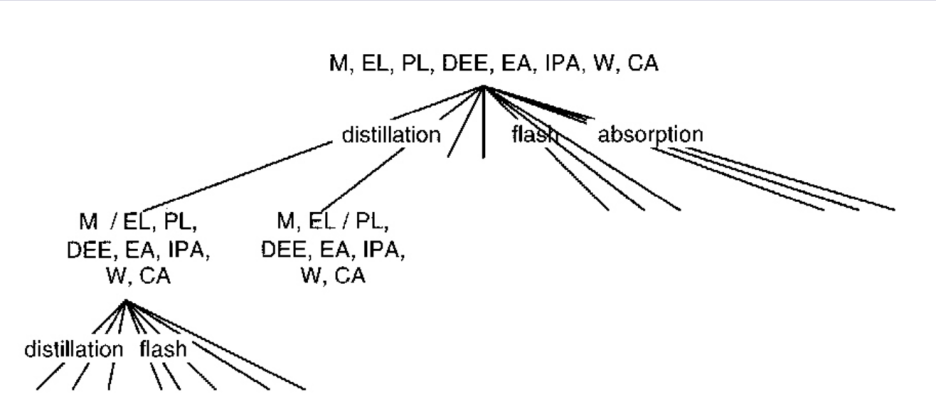
하나하나 보려니 대안이 너무 많다.. 특히 플래쉬는 압력과 온도를 조절하여 물질을 구분하는 방법인데, 압력과 온도를 어떻게 설정하냐에 따라 많은 가지가 나오게 된다.
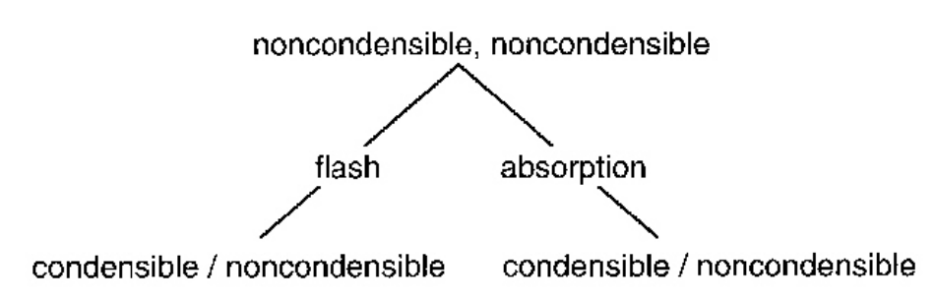
개별적으로 성분을 분리하려고 하기보다는 일단 큰 틀에서 쉽게 컨트롤할 수 있는 온도로 분리하는 방법을 생각해보자. 일반적으로 메탄. 에틸렌, 프로필렌은 온도가 낮아져도 응축하기 힘들고 디에틸에테르와 이소프로필알콜, 물, 크로톤알데하이드는 응축되기 쉽다. 따라서 다음과 같이 나눌 수 있다.
M:메탄 (공급 피드에 있는 불순물)
EL:에틸렌(반응 안된 것임)
PL:프로필렌 (공급 피드에 있는 불순물)
DEE: 다이에틸 에테르(Diethyl Ether)
EA:에탄올
IPA:이소프로필 알코올(Isopropyl Alcohol)
W:물
CA: 크로톤 알데하이드 C4H6O
중에서
M,EL,PL (비응축성, 항상 기체 상태) // DEE, EA, IPA, W, CA (응축성)
따라서 다음과 같은 분리가 가능하다.
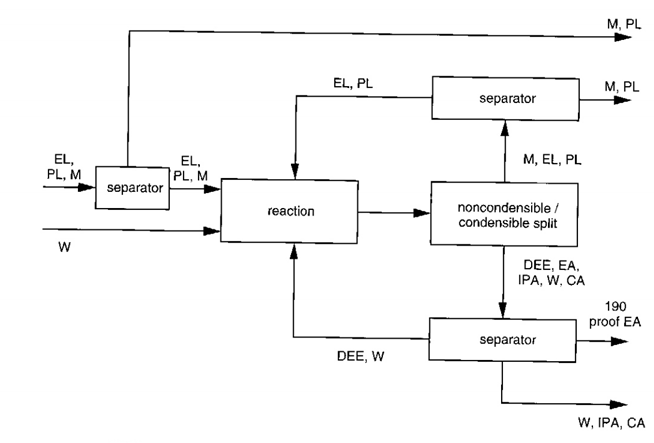
일단 반응기 이후만을 보면 된다.
1. M,EL,PL // DEE, EA, IPA, W, CA 분리한다.
2.DEE는 위에 평형상수 관련 이유로 재순환, W는 원료이므로 재순환
3.EA는 완제품이므로 따로 빼서 판매
4.IPA, CA는 폐기하도록 한다.
5.EL과 M을 분리하는 공정을 생각한 후 EL은 재순환시킨다.
자세히 살펴보자
1. 먼저 응축을 하게 되면 M,EL,PL // DEE, EA, IPA, W, CA가 분리된다.
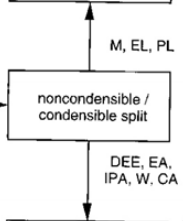
이후 여기서 기체 파트인 M,EL,PL을 다시 분리하도록 하자.
2. 먼저 제일 값싼 처리인 퍼지를 고려해볼 수 있다. 흐름 중에서 98%는 재순환 시키고 2%만을 제거하는 것이다. 이때 연소할 것인지, 연료로 쓸 것인지에 따라 처리 방법은 달라진다.
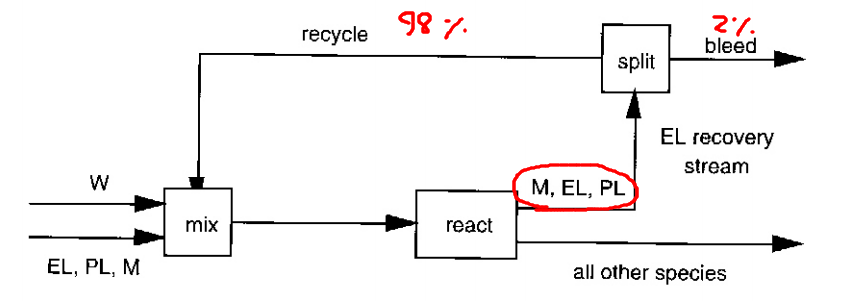
퍼지를 쓸 경우 공정도는 이렇게 된다. 반응기 후 응축으로 분리한 (그림에는 분리기가 표시되어 있지는 않다) M,EL,PL 중 2%는 내보내고 98%를 다시 리사이클하는 것이다. 이때 버려지는 흐름에는 반응물이 있기 때문에 많은 양을 버리는 것은 좋지 않다. 퍼지 분리를 적게 할 수록 재순환에서 메탄이 많아지지만, 그만큼 에틸렌은 더 적게 손실될 것이다. 따라서 재순환의 매우 적은 양만큼을 퍼지로 분리해야 한다. 그러나 가격이라는 변수가 있기에 몇%를 퍼지할지 정하는 것이 중요하다. 2%만 퍼지하는 것이 옳을까?
아쉽게도 이러한 퍼지의 효율 측정은 3장을 배운 뒤에나 가능하다. 따라서 지금은 2% 퍼지한다고 하자.
퍼지는 공정에 어쩔 수 없이 스며드는 오염물질을 내보내는 역할도 수행한다. 따라서 반드시 필요하다고 볼 수 있다.
3. 이제 액체 성분으로 분리된 DEE, EA, IPA, W, CA를 처리해야 한다.
액체를 플래쉬와 흡수탑에서 처리한 후 190도 에탄올을 생산물로 분리한다. 여기 포함된 모든 성분은 증류를 이용하여 분리하기 적합하다. 제거된 물을 다시 재활용하고 싶지만, 여기에 크로톤 알데하이드가 포함될 수 있기에 퍼지를 또 다시 도입해야 한다.
완성한 것은 다음과 같다. 아직 개선이나 분석, 열교환망의 설계가 이루어지지 않았지만, 그래도 일단 해냈다..
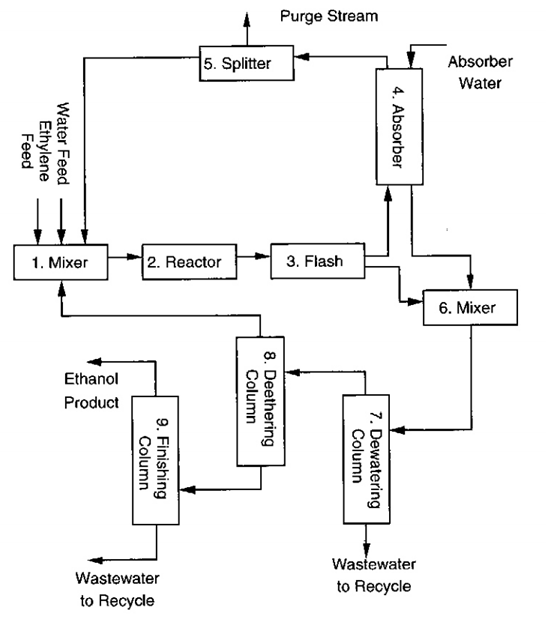
정리:
에탄올 공정의 합성 사례연구를 통해 한계값 결정 및 더글라스 계층구조를 적용하여 공정을 설계하는 방법에 대해서 배워보았다.
1.에탄올을 얼마 생산할 지 명확한 목표를 정의하고
2.정보수집을 하여
3.하나의 case를 찾아서 시작점으로 잡고 발전시켜 설계를 만들었다.
한계값 분석:생산품 가격-원가
더글라스 계층구조: 연속-입출력-재순환-분리체계까지 만들어보았다.
'화학공학 일지 > 화학공정설계' 카테고리의 다른 글
| ch3 : 공정 설계 개발 (5) | 2024.10.26 |
|---|---|
| 스미스의 화학공정설계: 제 3장. 반응기 조건 (1) | 2024.01.27 |
| 스미스의 화학공정설계: 제 2장. 화학 반응기의 선정 (1) | 2024.01.26 |
| 체계적인 화학공정 설계 (상) 독서노트 2 (0) | 2023.10.28 |
| 체계적인 화학공정 설계 (상) 독서노트 1 (0) | 2023.10.28 |